химическое равновесие.
3. Уравнения изохоры, изобары химической реакции
Зависимость


Уравнение изобары:

Уравнение изохоры:

По ним судят о направлении протекания реакции:

4. Расчет KP (метод Темкина-Шварцмана)
1-й способ:


термодинамический метод расчета
2-й способ:
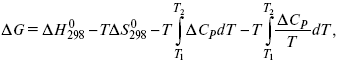

Пример. Расчет

Результаты вычислений занесены в таблицу 2.
Результаты вычислений


5. Расчет равновесного состава химического равновесия
Равновесный состав можно рассчитать только для газовой системы

равновесная концентрация.
Исходная концентрация всех компонентов

Изменение каждого компонента по числу молей (или стехиометрическому коэффициенту):

Она показывает изменение количества вещества по числу молей. Если реакция не началась, то
3H2 + N2 = 2NH3;
1,5H2 + 0,5N2 = NH3;
Рассчитать равновесный состав по третьему компоненту при условии, что

Рассчитываем по 4 компоненту:

Задача.
Газообразные вещества реагируют по уравнению:

Общее давление в газовой смеси –
Найти парциальное давление каждого компонента.
Вещества
Для того, чтобы найти парциальное давление, мы должны

где

где

где

Расчет
?
где ?


ЛЕКЦИЯ № 6. Химическая кинетика
1. Понятие химической кинетики
Кинетика – наука о скоростях химических реакций.
Скорость химической реакции – число элементарных актов химического взаимодействия, протекающих в единицу времени в единицу объема (гомогенные) или на единице поверхности (гетерогенные).
Истинная скорость реакции:

2. Факторы, влияющие на скорость химической реакции
Для гомогенных, гетерогенных реакций:
1) концентрация реагирующих веществ;
2) температура;
3) катализатор;
4) ингибитор.
Только для гетерогенных:
1) скорость подвода реагирующих веществ к поверхности раздела фаз;
2) площадь поверхности.
Главный фактор – природа реагирующих веществ – характер связи между атомами в молекулах реагентов.
Пример:
NO2 – оксид азота (IV) – лисий хвост, СО – угарный газ, монооксид углерода.
Если их окислить кислородом, то в первом случае реакция пойдет мгновенно, стоит приоткрыть пробку сосуда, во втором случае реакция растянута во времени.
Концентрация реагирующих веществ будет рассмотрена ниже.
Пример:

Голубая опалесценция свидетельствует о моменте выпадения серы, чем выше концентрация, тем скорость выше.

Чем больше концентрации Na2S2O3, тем меньше времени идет реакция. На графике (рис. 10) изображена прямо пропорциональная зависимость. Количественная зависимость скорости реакции от концент-рации реагирующих веществ выражается ЗДМ (законом действующих масс), который гласит: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Итак, основным законом кинетики является установленный опытным путем закон:

