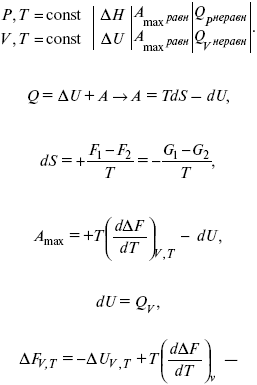
уравнение Гельмгольца (уравнение связывающее функции
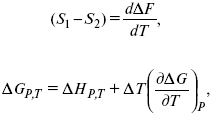
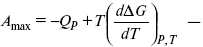
уравнение Гиббса (уравнение связывающее функции
Уравнения эти дают возможность рассчитать работу через температурный коэффициент функции Гельмгольца или через температурный коэффициент функции Гиббса.
Уравнение Клаузиуса-Клапейрона
Оно позволяет применить второй закон термодинамики к фазовым переходам. Если рассчитать процессы, в которых совершается только работа расширения, то тогда изменение внутренней энергии
Предположим, что 1 моль вещества переходит из первой фазы во вторую.
I фаза =>
II фаза =>
нет условного равновесия,
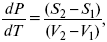
где
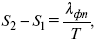
где
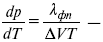
уравнение Клаузиуса-Клапейрона, дифференциальная форма уравнения.
Уравнение устанавливает взаимосвязь между теплотой фазового перехода, давлением, температурой и изменением молярного объема.
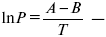
эмпирическая форма уравнения Клаузиуса-Клапейрона.
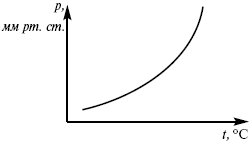
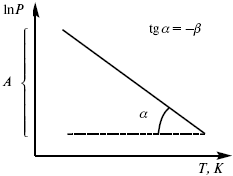
Уравнение Клаузиуса-Клапейрона изучает фазовые переходы. Фазовые переходы могут быть I рода и II рода.
I рода – характеризуются равенством изобарных потенциалов и скачкообразными изменениями
II рода – характеризуются равенством изобарных потенциалов, равенством энтропий и равенством молярных объемов.
I рода – ?
II рода – ?
Алгебраическая сумма приведенных теплот для любого обратимого кругового процесса равна нулю.
Эта подынтегральная величина – дифференциал однозначной функции состояния. Эта новая функция была введена
Любая система в различном состоянии имеет вполне определенное и единственное значение энтропии, точно так же, как определенное и единственное значение
Итак, энтропия выражается уравнением:
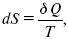
где
При независимых переменных
1) изобарно-изотермический потенциал (энергия Гиббса) при независимых переменных
2) изохорно-изотермический потенциал (энергия Гельмгольца) при независимых переменных
3) внутренняя энергия при независимых переменных:
4) энтальпия при независимых переменных:
5) энтропия при независимых переменных
В изолированных системах
Связь энтропии с другими термодинамическими параметрами
Для того, чтобы решить конкретную задачу, связанную с применением энтропии, надо установить зависимость между ней и другими термодинамическими параметрами. Уравнение
Записав уравнение:
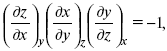
применительно к функциональной зависимости
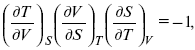
т. е.
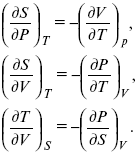
Теперь найдем зависимость энтропии от температуры из уравнений:
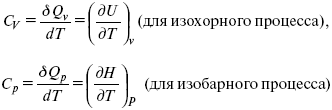
и
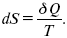
Вот эти зависимости:
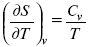
и
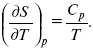
Эти два уравнения являются практически наиболее важными частными случаями общего соотношения:
Пользуясь разными зависимостями, можно вывести другие уравнения, связывающие термодинамические параметры.
Самопроизвольные – процессы, которые идут сами собой, на них не затрачивается работа, они сами могут производить ее (движение камней в горах, натрий с большой скоростью движется по поверхности, так как идет выделение водорода), а калий буквально «прыгает» по воде.
Несамопроизвольные – процессы, которые не могут идти сами собой, на них затрачивается работа.
Равновесие делится на устойчивое, неустойчивое и безразличное.
Постулаты второго закона термодинамики.
1. Постулат Клаузиуса – «Не может быть перехода тепла от менее нагретого к более нагретому

