'семействами'. Если мы нашли одну точку, - через которую можно провести ось (или плоскость) симметрии, то найдем быстро и соседнюю и далее на таком же расстоянии третью и четвертую и т. д. точки, через которые проходят такие же оси (или плоскости) симметрии.
17 типов симметрии плоского узора не исчерпывают, конечно, всего разнообразия узоров, составляемых из одной и той же фигурки; художник должен указать еще одно обстоятельство: как расположить фигурку по отношению к граничным линиям ячейки. На рис. 2.12 показаны два узора обоев с той же исходной фигуркой по различно расположенной по отношению к зеркалам. Оба эти узора относятся к случаю 8.
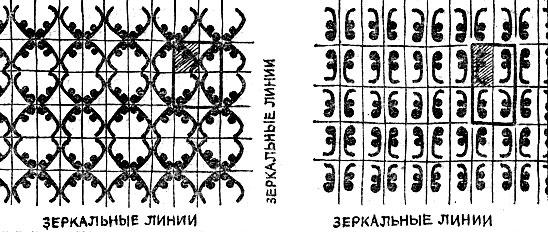
Каждое тело, в том числе и кристалл, состоит из атомов. Простые вещества состоят из одинаковых атомов, сложные - из атомов двух или нескольких сортов. Предположим, что мы могли бы в сверхмощный микроскоп рассмотреть поверхность кристалла поваренной соли и увидеть центры атомов. Рис. 2.13 показывает, что атомы расположены вдоль грани кристалла, как узор обоев. Теперь вы уже можете легко понять, как построен кристалл. Кристалл представляет собой 'пространственные обои'. Пространственные, т. е. объемные, а не плоские элементарные ячейки - это 'кирпичи', прикладыванием которых друг к другу в пространстве строится кристалл.

Сколько же способов построения 'пространственных обоев' из элементарных кусков? Эта сложная математическая задача была решена в конце прошлого века Евграфом Степановичем Федоровым. Он доказал,; что должны существовать 230 способов построения кристалла.
Все современные данные о внутреннем строении кристаллов получены при помощи рентгеноструктурного анализа, о котором мы расскажем в книге 4.
Существуют простые кристаллы, построенные из атомов одного сорта. Например, алмаз - это чистый углерод. Кристаллы поваренной соли состоят из ионов двух сортов: натрия и хлора. Более сложные кристаллы могут быть построены из молекул, которые в свою очередь состоят из атомов многих сортов.
Однако в кристалле всегда можно выделить наименьшую повторяющуюся группу атомов (в простейшем случае это будет один атом), иными словами, элементарную ячейку.
Размеры ячейки могут быть весьма различными. Наименьшие расстояния между соседними узлами (вершинами ячейки) встречаются у простейших кристаллов, построенных из атомов одного вида, наибольшие - у сложных кристаллов белка. Расстояния колеблются от 2-3 до нескольких сот ангстремов (стомиллионных долей сантиметра).
Кристаллические решетки очень разнообразны. Однако свойства, общие для всех кристаллов, безупречно объясняются решетчатым строением кристаллов. Прежде всего нетрудно понять, что идеально плоские грани - это плоскости, проходящие через узлы, в которых сидят атомы. Но узловых плоскостей можно провести сколько угодно по самым различным направлениям. Какие же из этих узловых плоскостей ограничивают выросший кристалл?
Обратим внимание прежде всего на следующее обстоятельство: разные узловые плоскости и линии заполнены узлами не одинаково плотно. Опыт показывает, что кристалл огранен плоскостями, которые гуще всего уееяны узлами, плоскости же пересекаются по ребрам, в свою очередь наиболее густо заселенным узлами.
Рис. 2.14 дает вид кристаллической решетки перпендикулярно к ее грани; проведены следы некоторых узловых плоскостей, перпендикулярных к чертежу. Из сказанного ясно, что у кристалла могут развиться грани, параллельные узловым плоскостям I и III, и не будет граней, параллельных редко усеянным узлами плоскостям II.

В настоящее время известно строение многих сотен кристаллов. Расскажем про строение простейших кристаллов и прежде всего тех, которые построены из атомов одного сорта.
Наиболее распространены три типа решеток. Они показаны на рис. 2.15. Точками изображены центры атомов; линии, объединяющие точки, не имеют реального смысла. Они проведены лишь для того, чтобы сделать читателю более ясным характер пространственного расположения атомов.
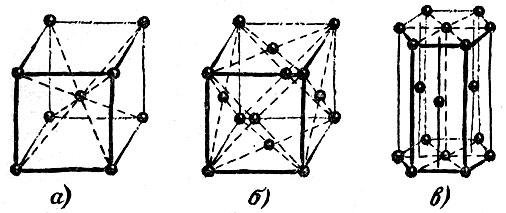
Рис. 2.15,
Третья решетка (рис. 2.15,

Центры атомов в гексагональной плотнейшей решетке расположены так, как центры шаров, плотно уложенных описанным способом.
В описанных трех решетках кристаллизуется множество элементов:
Гексагональная плотнейшая упаковка..... Be, Co, Hf, Ti, Zn, Zr
Кубическая гранецентрированная......... А1, Си, Со, Fe, Au, Ge, Ni, Ti
Кубическая объемно-центрированная........ Cr, Fe, Li, Mo, Ta§ Ti, U, V
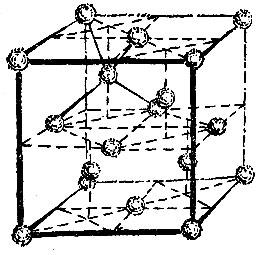
Из других структур упомянем лишь немногие. На рис. 2.17 изображена структура алмаза. Для этой структуры характерно то, что атом углерода алмаза имеет четыре ближайших соседа. Сопоставим это число с соответствующими числами описанных только что трех наиболее распространенных структур. Как видно из рисунков, в плотнейшей гексагональной упаковке у каждого атома 12 ближайших соседей, столько же соседей у атомов, образующих гранецентрированную кубическую решетку; в объемно-центрированной решетке у каждого атома 8 соседей.
Несколько слов скажем о графите, строение которого показано на рис. 2.18. Особенность этой структуры бросается в глаза. Графит состоит из слоев атомов, причем атомы одного слоя связаны между собой сильнее, чем атомы соседних слоев. Это связано с величиной межатомных расстояний: расстояние между соседями в одном слое в 2,5 раза меньше кратчайшего расстояния между слоями.
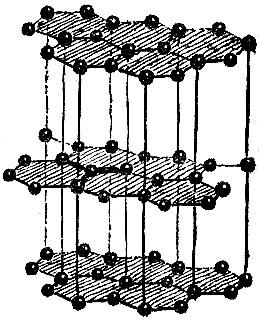
Наличие слабо связанных атомных слоев приводит к тому, что кристаллы графита легко расщепляются вдоль этих слоев. Поэтому твердый графит может служить смазочным материалом в тех случаях, когда невозможно применять смазочные масла,- например, при очень низких или очень высоких температурах. Графит - твердый смазочный материал.

