Многие органические соединения также образуют водородные связи; важную роль водородная связь играет в биологических процессах.
1. Вещества только с ковалентными связями – это
1) SiH4, Сl2O, СаВr2
2) NF3, NH4Cl, P2O5
3) CH4, HNO3, Na(CH3O)
4) CCl2O, I2, N2O
2–4. Ковалентная связь
2. одинарная
3. двойная
4. тройная
присутствует в веществе
1) КСl
2) N2
3) S2
4) H2S
5. Кратные связи имеются в молекулах
1) HCOOH
2) ССl4
3) С3Н8
4) С3Н4
6. Частицы, называемые радикалами, – это
1) SO2
2) СlO2
3) С2Н6
4) С2Н5
7. Одна из связей образована по донорно-акцепторному механизму в наборе ионов
1) SO42-, NH4+
2) H3O+, NH4+
3) PO43-, NO3-
4) PH4+, SO32-
8. Наиболее прочная и короткая связь – в молекуле
1) Н2O
2) H2S
3) HF
4) PH3
9. Вещества только с ионными связями – в наборе
1) HCl, КСl
2) NH4Cl, SiCl4
3) NaF, CsCl
4) Nal, P2O5
10–13. Кристаллическая решетка вещества
10. Si
11. H2SO4
12. Cr
13. Ва(ОН)2
1) металлическая
2) ионная
3) атомная
4) молекулярная
4. Классификация и взаимосвязь неорганических веществ
Классификация неорганических веществ базируется на
Элементы условно делятся на элементы с металлическими и неметаллическими свойствами. Первые из них всегда входят в состав катионов многоэлементных веществ
Классификация простых и сложных неорганических веществ приведена в табл. 6.
Ниже приводятся определения (дефиниции) классов неорганических веществ, их важнейшие химические свойства и способы получения.
Неорганические вещества – соединения, образуемые всеми химическими элементами (кроме большинства органических соединений углерода). Делятся по химическому составу:
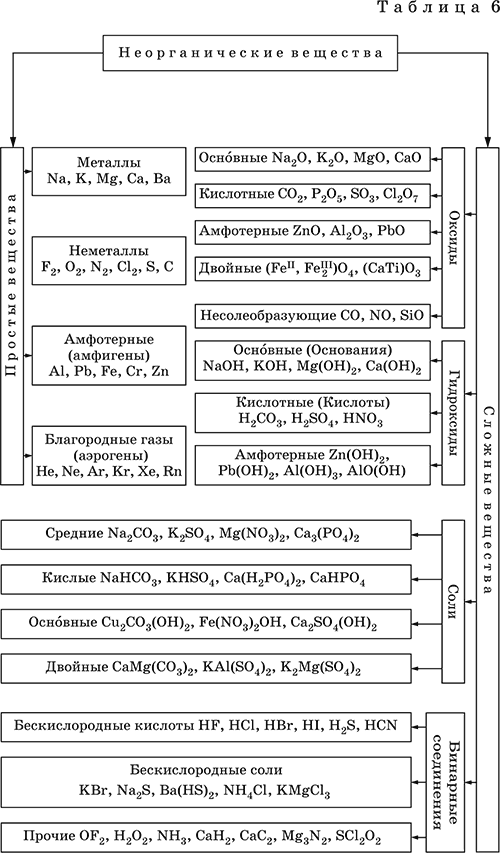
Простые вещества образованы атомами одного элемента. Делятся по химическим свойствам:

Металлы – простые вещества элементов с металлическими свойствами (низкая электроотрицательность). Типичные металлы:
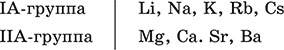
Металлы обладают высокой восстановительной способностью по сравнению с типичными неметаллами. В электрохимическом ряду напряжений они стоят значительно левее водорода, вытесняют водород из воды (магний – при кипячении):
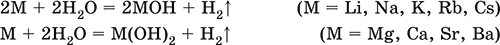
Простые вещества элементов Cu, Ag и Ni также относят к металлам, так как у их оксидов CuO, Ag2O, NiO и гидроксидов Cu(OH)2, Ni(OH)2 преобладают основные свойства.
Неметаллы – простые вещества элементов с неметаллическими свойствами (высокая электроотрицательность). Типичные неметаллы: F2, Cl2, Br2, I2, O2, S, N2, Р, С, Si.
Неметаллы обладают высокой окислительной способностью по сравнению с типичными металлами.
Амфигены – амфотерные простые вещества, образованные элементами с амфотерными (двойственными) свойствами (электроотрицательность промежуточная между металлами и неметаллами). Типичные амфигены: Be, Cr, Zn, Аl, Sn, Pb.
Амфигены обладают более низкой восстановительной способностью по сравнению с типичными металлами. В электрохимическом ряду напряжений они примыкают слева к водороду или стоят за ним справа.
Аэрогены – благородные газы, одноатомные простые вещества элементов VIIIA- группы: Не, Ne, Ar, Kr, Xe, Rn. Из них He, Ne и Ar химически пассивны (соединения с другими элементами не получены), а Kr, Хе и Rn проявляют некоторые свойства неметаллов с высокой электроотрицательностью.
Сложные вещества образованы атомами разных элементов. Делятся по составу и химическим свойствам:
Оксиды – соединения

